
点击右上角![]() 微信好友
微信好友
 朋友圈
朋友圈

请使用浏览器分享功能进行分享

我们每个人最初都只是一个小小的受精卵,它所带有的DNA和后来的皮肤细胞、心脏细胞没差别,怎么就能变出200多种不一样的细胞?
在2025WAFI国际智能育种论坛上,中国科学院院士、同济大学教授、院长高绍荣带来了答案——这背后藏着“表观遗传”的神奇力量。
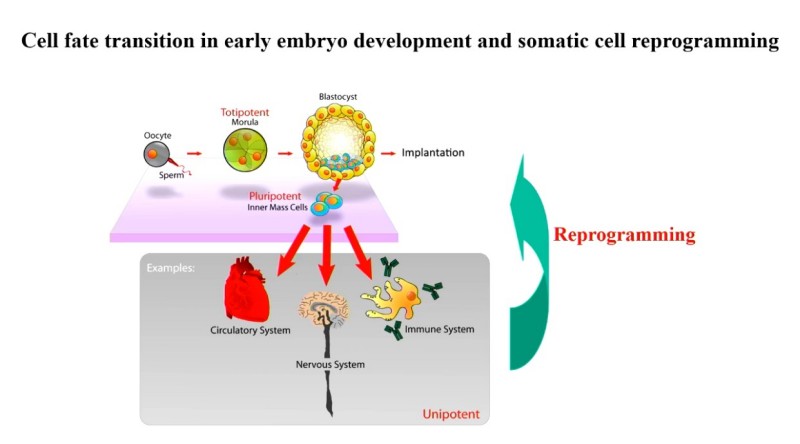
早期胚胎发育与体细胞重编程中的细胞命运转变。图源演讲者幻灯片
什么是“表观遗传”?如果把细胞里的DNA比作一本固定的“遗传剧本”,那“表观遗传”就是给剧本贴的各种“小标签”:有的标签会让某个基因“上台表演”,也就是激活它表达;有的标签会让基因“安静待着”,也就是抑制它。这些标签不改变DNA本身,却能决定细胞的“命运”——它会变成什么样子、怎么发育。高绍荣团队主要对两种“标签”进行研究:一种是给包裹DNA的“组蛋白”加修饰,另一种是给RNA加修饰,就是这两种修饰在悄悄指挥细胞和胚胎的生长。
团队最先研究的是正常胚胎发育里这些“标签”的作用。他们发现,组蛋白上的修饰特别关键,比如两种常见的“标签”:H3K4三甲基化是“启动键”,贴上它基因就会开始工作;H3K27三甲基化是“暂停键”,贴上它基因就会歇着。更有意思的是干细胞里的情况,有些基因会同时贴着“启动键”和“暂停键”,这叫“Bovalent现象”,正是这种现象让干细胞能保持“万能”——能变成各种细胞,要是没了这个现象,干细胞很快就会定型,没法再灵活转变了。
还有一种叫H3K9三甲基化的修饰,像个“守护者”,我们基因组里有很多会乱跳的“捣乱片段”叫转座子,这种修饰能把它们“锁住”,尤其是胚胎早期,能防止这些片段搞破坏,让胚胎顺利发育。而且团队在小鼠和人的早期胚胎里都看到了这种规律,说明这些发现对人类研究也有用。
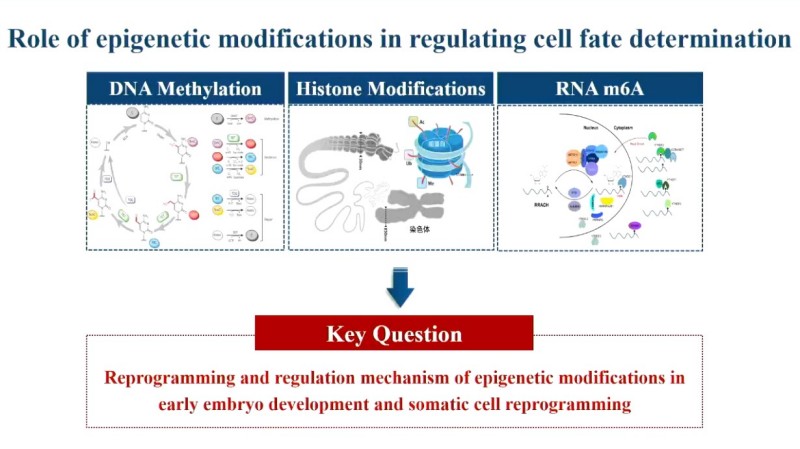
表观遗传修饰在决定细胞命运调控中的作用。图源演讲者幻灯片
除了组蛋白修饰,RNA上的修饰也很重要。卵母细胞是体内最大的细胞,里面存了好多“母源RNA”,这些RNA是早期胚胎的“能量补给”。团队发现一种叫m6A的RNA修饰,在不同阶段作用完全不一样:在卵母细胞里,它是“稳定剂”,让母源RNA保持完好,给胚胎供能;可到了胚胎发育的二细胞阶段,它又变成“清理工”,新产生的RNA贴上它就会被快速降解,就像及时清掉旧材料,给新的发育腾出空间。要是把负责加这种修饰的酶去掉,胚胎就没法正常长,这也说明RNA修饰是胚胎发育中缺不得的角色。
这些发现能够帮助解决育种领域的一个老难题——克隆效率低。大家熟悉的克隆羊多莉,其实只是少数成功案例,早期克隆胚胎能长成个体的概率还不到1%,大部分胚胎都会“卡住”没法继续发育。团队找了半天原因,终于发现问题出在“标签”上:克隆时,体细胞的“表观标签”没重置好,像之前说的H3K9、H3K4这些修饰,在克隆胚胎里没法像正常胚胎那样贴对,导致基因表达乱了套,胚胎自然就长不动了。
找到症结后,他们针对性地修正了这些“标签缺陷”,让克隆胚胎的“基因开关”恢复正常,结果小鼠的克隆胚胎发育率从不到1%提到了接近20%。这种方法不光能用于小鼠,还能用到克隆羊、克隆猪、克隆牛这些大动物身上,以后能大幅提高大动物的克隆效率,给育种提供更多优质个体。
小白鼠。图片由AI生成
在让克隆胚胎“活”得更好之外,对细胞命运的调控研究,还打开了另一个新方向——不用真实胚胎,也能在体外研究发育。
研究人类胚胎有个难题,体外培养不能超过14天,没法看到完整的发育过程,于是团队想,能不能用干细胞拼一个“类胚胎”?这种类胚胎不是真的胚胎,却能模拟正常胚胎的生长。他们先观察到,正常胚胎发育到2.5天时,有些细胞既表达能发育成胎儿的OCT4基因,又表达能发育成胎盘的CDX2基因,这些细胞分化潜力特别好。于是团队尝试在体外建这种细胞系,筛选了2000种化合物后,终于找到两种小分子,加进去后,原本只表达OCT4的干细胞,也开始表达CDX2,变成了“双能干细胞”——既能变胎儿细胞,又能变胎盘细胞,放进胚胎还能参与形成个体,功能完全没问题。
之后,把这种双能干细胞放在体外培养,让它们自己组装成类胚胎,结果特别惊喜:这些类胚胎能发育到类似正常胚胎7.5到9天的阶段,能长出神经管——未来会变成大脑和脊髓,还有8到9对体节——未来会变成骨骼和肌肉,甚至还能长出会跳动的心脏。
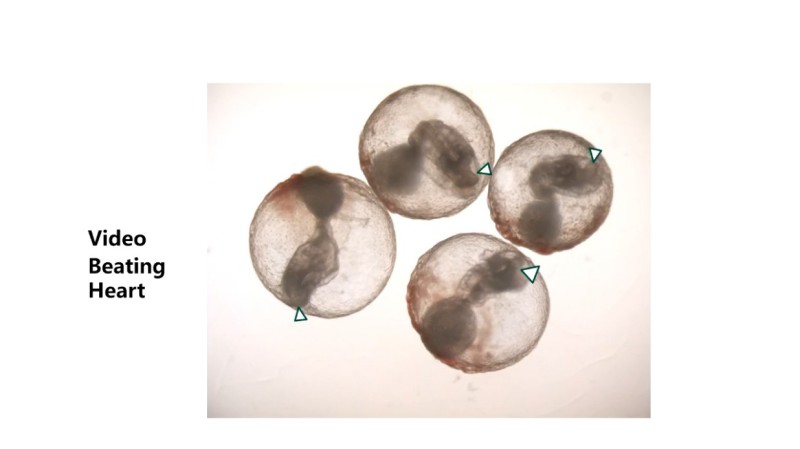
类胚胎形成心脏。图源演讲者幻灯片
这些在小鼠身上的发现,并不是停留在实验室里。高绍荣提到,他们已经开始把成果往大动物上延伸,比如提高克隆效率的方法、培养双能干细胞的技术,以后都可能用到猪、牛、羊的育种里,帮着培育更优质、更抗病的品种。对智能育种来说,这些发现就像打开了一扇新门,以后或许能通过调控“表观标签”,更精准地控制动物的发育和性状,培育出更符合需求的优良品种。
记者:李欣哲
技术支持:光明智会系统
